西京结构文献谈|3D打印、计算机建模和人工智能在结构性心脏病中的应用展望Issuing time:2022-02-09 09:00  毛予、翟蒙恩、金屏、刘洋、杨剑 //////////////////////////////////////// 结构性心脏病(structural heart disease,SHD)是近年来心血管领域发展最快、成果最多的方向之一。传统影像检查多用于疾病诊断,在SHD治疗方面的作用略显不足。SHD的治疗,特别是介入治疗,需要影像学数据在手术规划、手术模拟以及术中预测方面提供更多的辅助和支持。相较于SHD外科手术,介入治疗没有外科开放术野和直接触觉反馈。因此,基于围术期中对影像学的需要,手术操作方式、视野概念和围术期规划技术得以迅猛发展,不断拓展了临床器械设备的开发,提高了医生培训的教学工作质量,与患者之间的沟通更加顺畅。3D打印在临床管理和围术期规划中的应用明显缩短了初学者学习曲线,3D打印结合计算机建模,加速了设备测试中对流体力学的研发和理解,3D打印、计算机建模和人工智能的有效整合正在逐步改变医生培训模式和以患者为中心的医疗服务模式。 Highlight 本文亮点:  1)结构性心脏病治疗需要医师深入理解心脏的病理生理学; 2)3D打印技术可以明显缩短新技术新业务的学习曲线; 3)计算建模有助于模拟心脏病理生理状态下的物理生理特性; 4)AI技术有助于构建患者特异性解剖结构,进而促进手术模拟培训。 3D打印技术概述 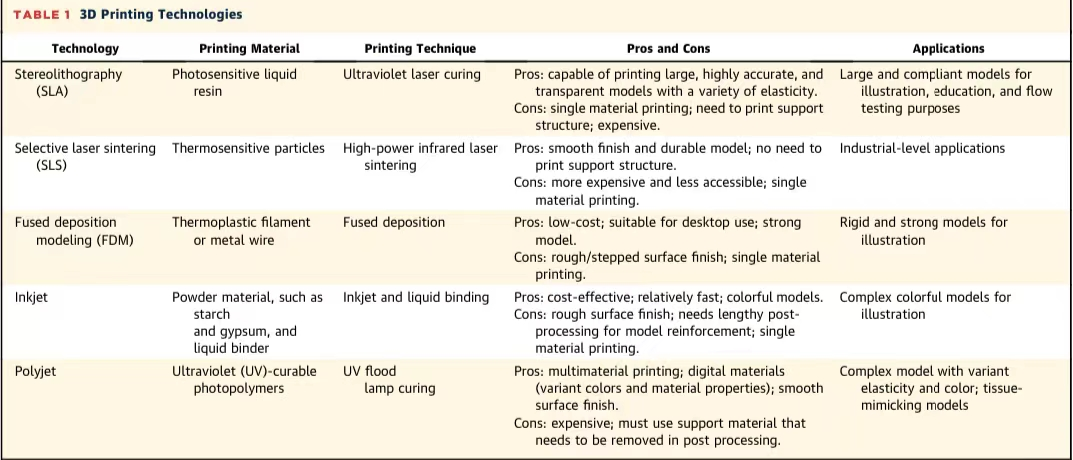 表1 3D打印技术种类 心血管疾病3D打印建模具体流程如下: 4)调整后,将STL文件导出用于3D打印(图1)。 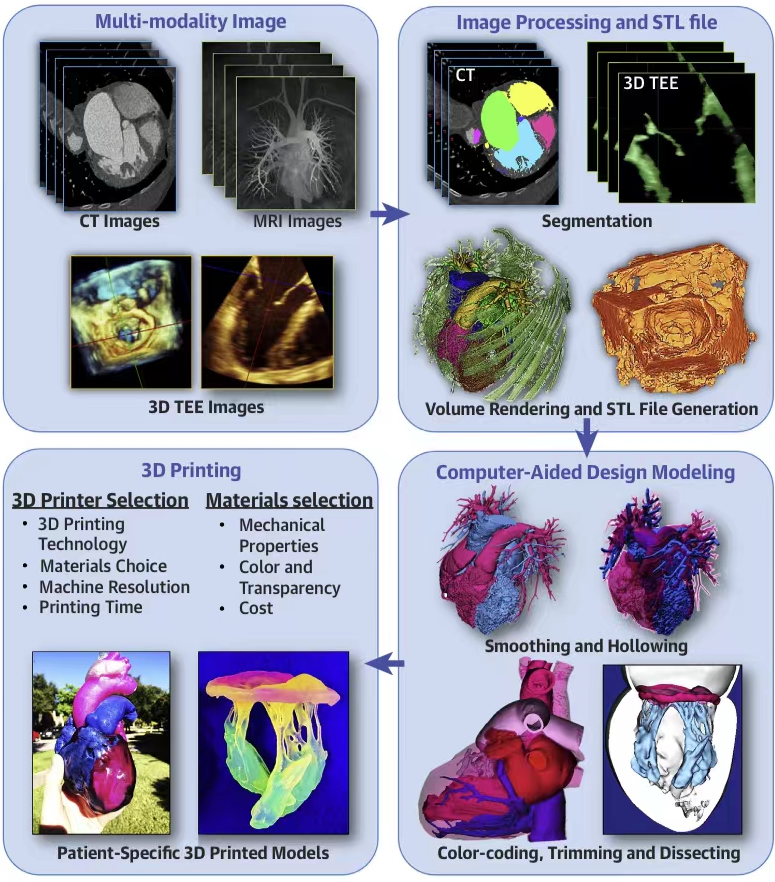 图1 心血管3D打印流程 3D打印技术在结构性心脏病中的应用 3D打印在经导管主动脉瓣置换术(TAVR)中的应用 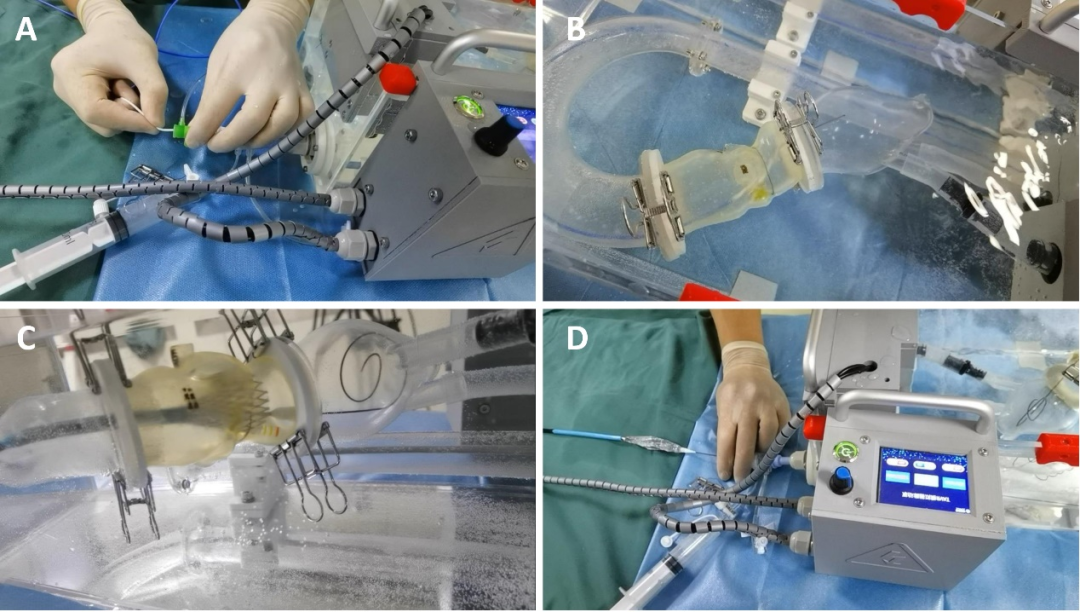 图2 西京医院3D打印心血管模型体外TAVR手术模拟 3D打印在经皮二尖瓣修复术中的应用 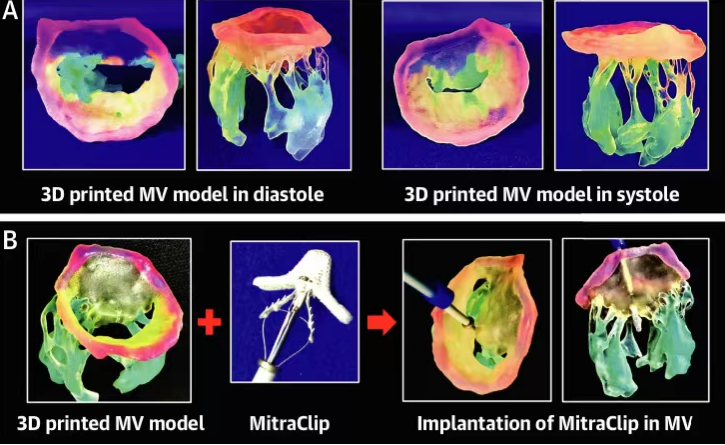 图3 二尖瓣复合体3D打印模型及MitraClip植入模拟   图4 西京医院3D打印二尖瓣模型体外进行经导管二尖瓣修复手术模拟 3D打印及虚拟模拟在经导管二尖瓣置换术中的应用 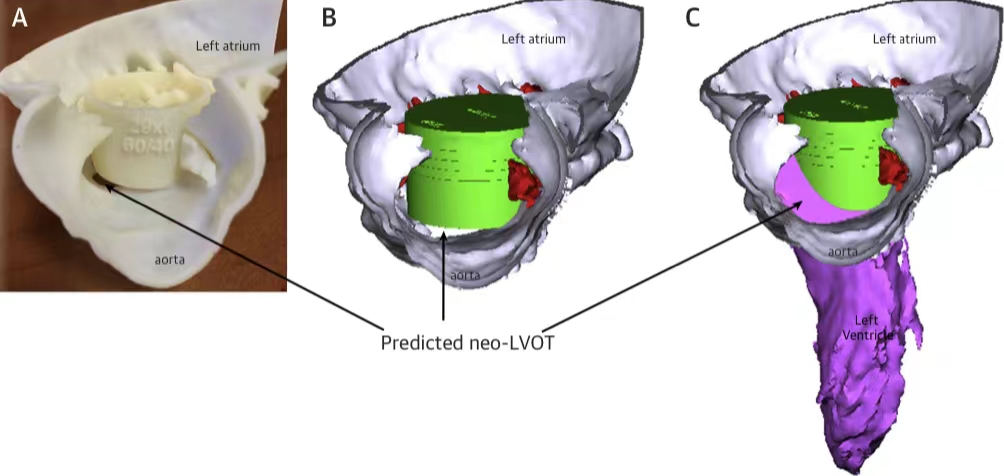 图5 二尖瓣3D打印模型模拟瓣膜植入以及LVOT梗阻风险评估 3D打印在左心耳封堵术中的应用 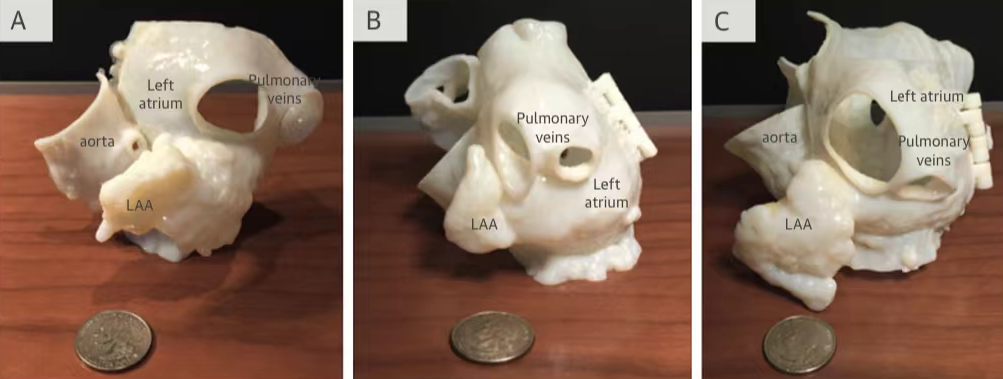 图6 左心耳3D打印模型 3D打印在经导管三尖瓣修复/置换术中的应用 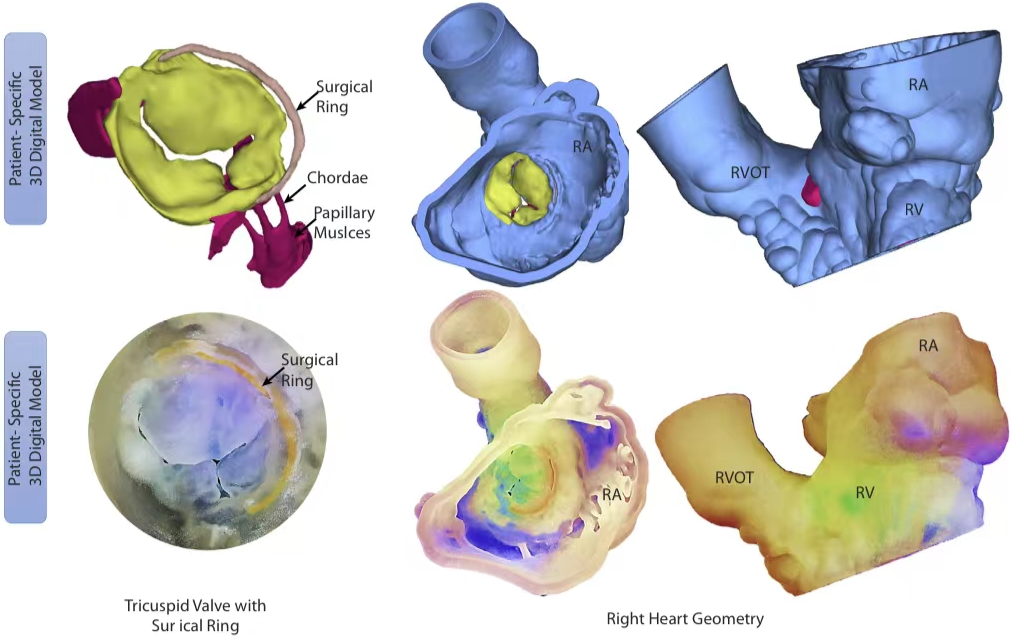 图7 三尖瓣和右心的3D重建结构模型 对患者的教育指导 目前3D打印的局限性 理想情况下,心血管3D打印模型应能够同时展现活体器官的解剖特征和生物特性。对于体外测试和/或手术模拟,3D打印模型最好能模拟心脏在整个心动周期中的动态变化;然而,目前材料尚无法满足模拟心脏的非线性和各向异性表现。为了能够使3D打印更好地模拟器官的形态和生物特性,必须对3D打印材料做进一步深入研究。 计算机建模概述 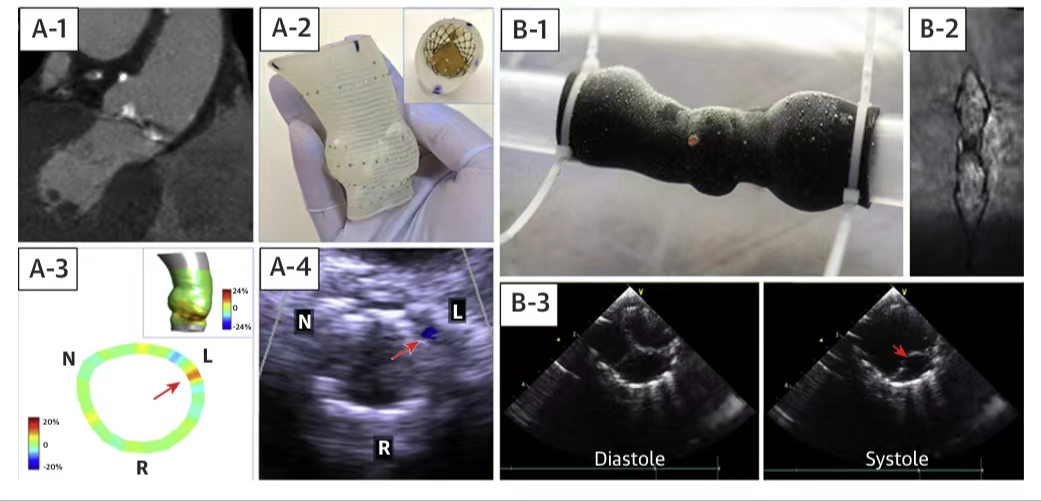 图8 3D打印模型在介入瓣膜体外模拟中的应用 注:A-1:CT获取原始数据;A-2:在3D打印的主动脉根部模型释放TAVR瓣膜;A-3:测量瓣环各处径向受力情况;A-4:预测术后瓣周漏情况;B-1:将3D模型连接到搏动血流模拟器上;B-2,3:核磁和超声检测血流状态以及瓣叶活动度。 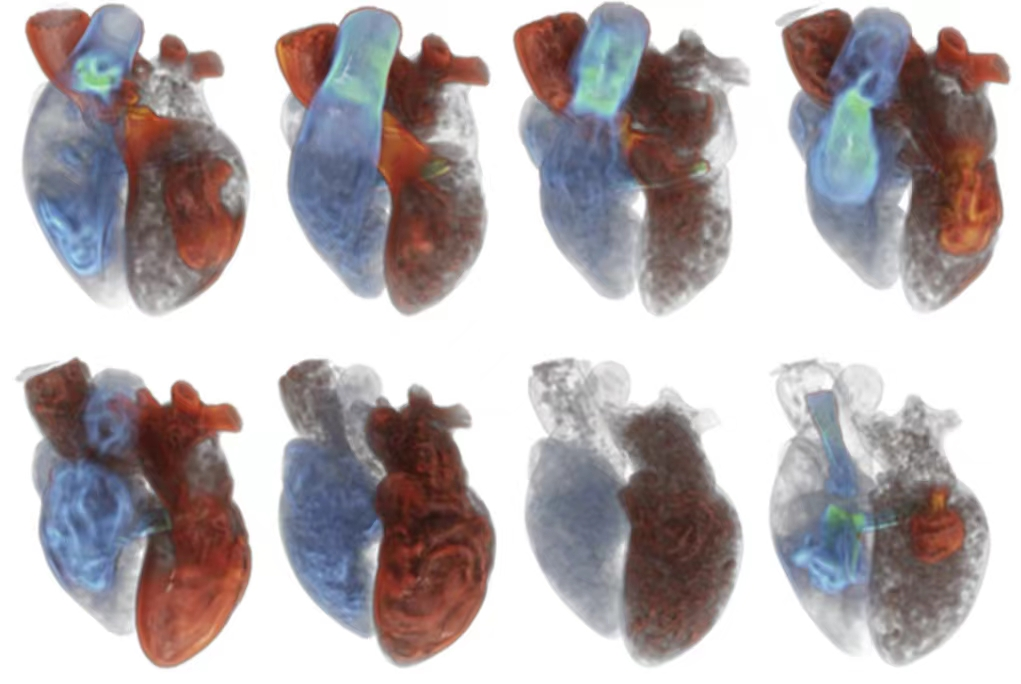 图9 计算机建模及心脏血流动力学情况展示 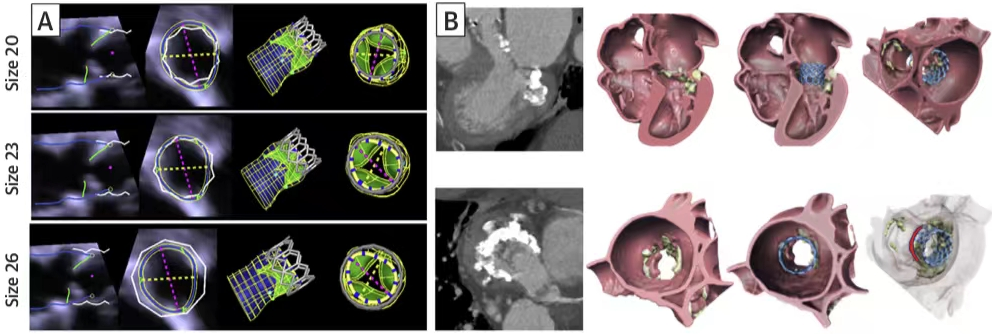 图10 计算机模拟植入介入瓣膜 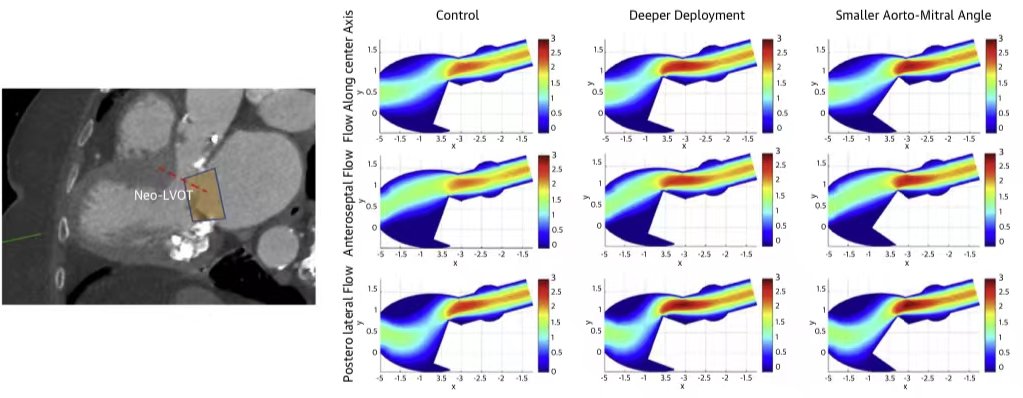 图11 运用CFD评估TMVR术后的LVOT梗阻 人工智能在结构性心脏病中的作用 AI技术助力SHD介入治疗 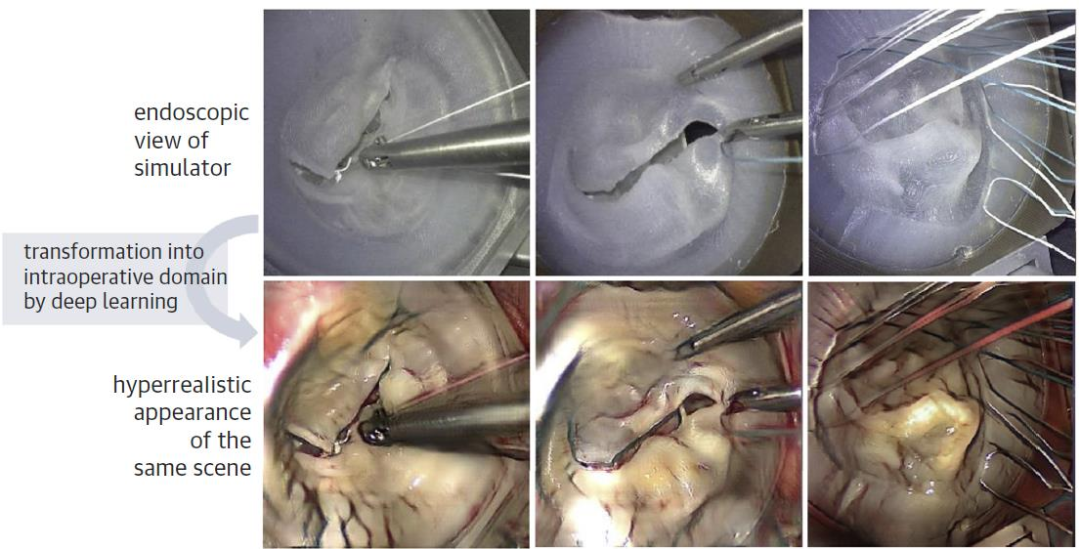 图12 AI技术将模拟的术中影像优化得更加逼真 AI技术在介入医生和介入影像医生培训中的应用 AI技术的其他应用 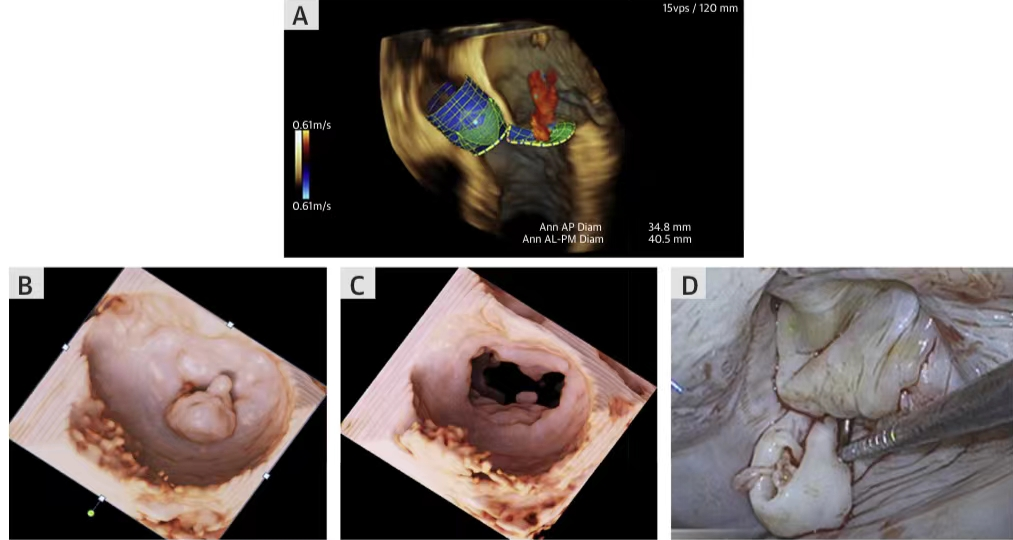 图13 对3D打印进行实时色彩渲染 注:A:实时3D TEE影像;B和C:AI通过对3D TEE影像进行色彩渲染,可清晰显示二尖瓣收缩期和舒张期P2区域腱索断裂和瓣叶脱垂;D:该病例的术中影像。 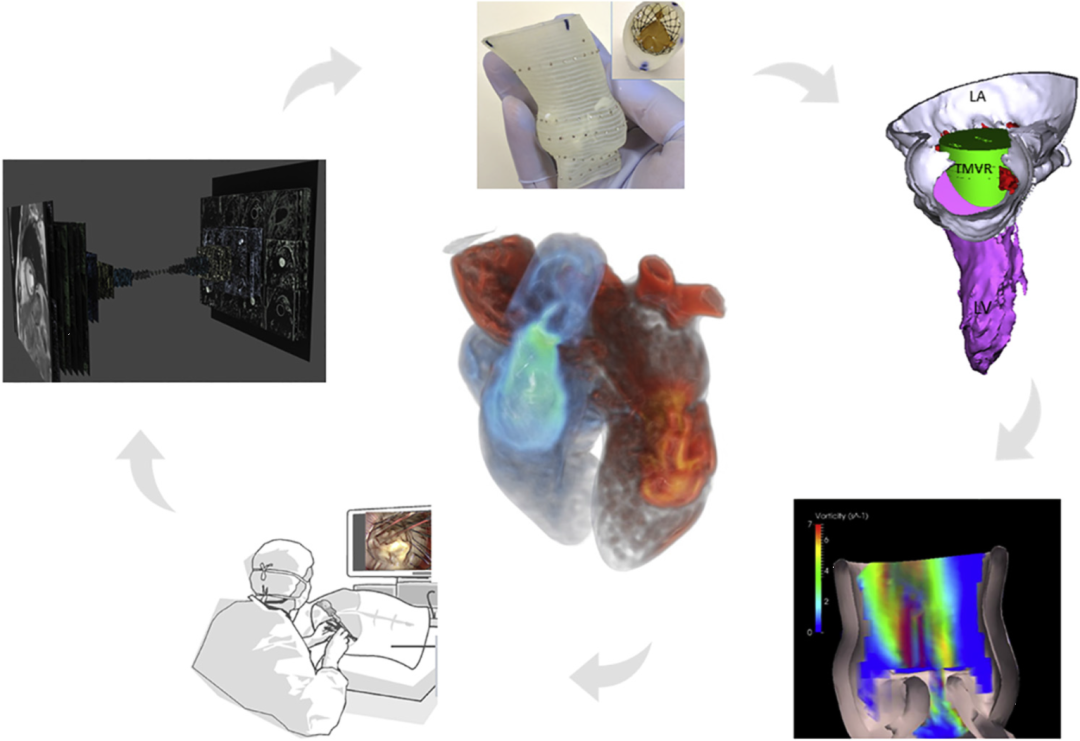 图14 现代化医疗模式 注:将3D打印技术、手术模拟、流体建模和AI整合,是将来临床培训、器械研发和精准医疗的重要发展方向。 需要解决和克服的技术挑战 当前,AI在实际应用中的主要挑战是大量非结构化临床数据的存在。数据收集的基础是合适的源图像、服务器之间文件转换的兼容性,以及直接上传到“学习云”的效率。一旦上传的数据被整合到“学习云”中的现有数据集中,AI算法将被激活和改进,新数据将被用来组成更精简的流程。随着新数据集被添加到其训练集中,AI 算法也将变得更加准确和高效。 结论 致谢:感谢西安马克医疗科技有限公司提供影像学素材及技术支持!
专家简介
杨剑 空军军医大学西京医院 心血管外科一病区主任,博士研究生导师。曾于德国洪堡大学Charité医学院、德国柏林心脏中心、美国Cleveland Clinic医学中心等国际知名医学中心访问研修。担任美国心脏协会专家会员(FAHA)、 美国心脏病学会专家会员(FACC)、中国医师协会心血管外科医师分会结构性心脏病专业委员会副主任委员、中华医学会胸心血管外科分会第九届委员会青年委员、陕西省医疗器械不良事件监测专家咨询评价委员会专家。获聘陕西省中青年科技创新领军人才、陕西省科技创新团队带头人,为陕西省自然科学基础研究计划杰出青年科学基金项目获得者、西安交通大学兼职教授。担任Eur Heart J, BMJ,AJC等杂志特邀审稿人,《中华胸心血管外科杂志》、《心脏杂志》、《中国体外循环杂志》、《心血管外科杂志》、《精准医学杂志》编委。临床专长于复杂结构性心脏病的微创及介入治疗,在国内较先开展了经导管肺动脉瓣置换、主动脉瓣置换、二尖瓣修复、二尖瓣置换以及瓣周漏封堵等创新性技术。主要科研方向为结构性心脏病诊疗新技术以及心肌细胞损伤修复、重构和再生的临床转化研究。在微创心血管器械研发、临床转化及以3D打印为主的多模态影像学评估方面有一定建树。先后在Eur Heart J,JACC等国际期刊上以第一或通讯作者发表SCI论文30余篇,被Circulation,JACC等国际权威杂志引用500次,承担十三五国家重点研发计划、国家自然科学基金等10余项基金,经费1000余万元。荣获国家科技进步二等奖、中华医学科技一等奖、中华医学会胸心血管外科分会Lillehei奖学金“菁英奖”、中国医师协会胸心血管外科分会优秀青年医师“杏林奖”等奖励。授权国家专利20余项,出版专著、译著12部。
刘洋 空军军医大学西京医院 博士,副主任医师,副教授,硕士研究生导师。美国马里兰大学医学院博士后。 国家心血管病专家委员会微创心血管外科专业委员会委员。专注心血管疾病微创治疗。先后开展经皮微创介入瓣膜病修复及置换术,瓣膜置换术后瓣周漏介入封堵术,主动脉缩窄球囊扩张支架置入术,冠状动脉漏介入封堵术等多项心血管疾病微创治疗新技术。在国内外发表研究论著50余篇,其中SCI论著21篇;主持军队重大专项子课题1项,国家自然科学基金1项,军队及省部级课题各7项;参加 “十二五”、“十三五”国家重大科技专项等课题13项。获国家专利20项;主编专著1部,副主编2部,参编专著8部。先后获得美国ASAIO青年医师奖,Euro-ELSO青年研究者奖,中国医师协会心血管外科分会杏林奖,中华医学会胸心血管外科分会Lillehei 奖学金及厄尔巴肯奖学金。 |